Cyanin5.5-Azid
| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 14030 | 100 uL, 10 mM/DMSO |
–
|
Auf Lager | |
| 34030 | 500 uL, 10 mM/DMSO |
$199
|
Auf Lager | |
| 44030 | 1 mL, 10 mM/DMSO |
$495
|
Auf Lager | |
| A4030 | 1 mg |
–
|
Auf Lager | |
| B4030 | 5 mg |
$199
|
Auf Lager | |
| C4030 | 10 mg |
$297
|
Auf Lager | |
| D4030 | 25 mg |
$495
|
Auf Lager | |
| E4030 | 50 mg |
$895
|
Auf Lager | |
| F4030 | 100 mg |
$1490
|
Auf Lager |

Einen günstigeren Preis gefunden?
Lassen Sie es uns wissen
und wir unterbreiten Ihnen ein besseres Angebot!
Dieses Farbstoffazid ist ein Markierungsreagenz für die Click-Chemie und erhältlich als 10-mM-Lösung in DMSO oder als Feststoff. Cyanin5.5 ist ein im Fernrotbereich emittierender Fluorophor, der als Alternative zu Cy5.5® und DyLight 680 verwendet werden kann.
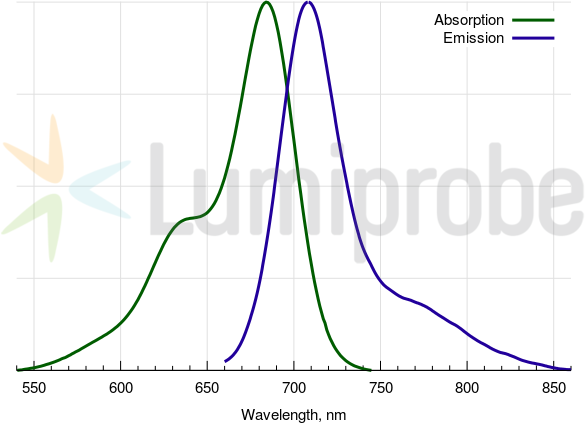
Absorptions- und Emissionsspektren von Cyanin 5.5
Kunden kauften zusammen mit diesem Produkt
Allgemeine Eigenschaften
| Erscheinungsform: | dunkelvioletter Feststoff/ dunkelblaue Lösung |
| Molekülmasse: | 701.34 |
| Molekülformel: | C43H49ClN6O |
| Löslichkeit: | löslich in organischen Lösungsmitteln (DMSO, DMF, Dichlormethan), geringe Löslichkeit in Wasser |
| Qualitätskontrolle: | NMR 1H, HPLC-MS (95 %) |
| Lagerungsbedingungen: | Lagerbeständigkeit: 24 Monate ab dem Wareneingang bei −20 °C an einem lichtgeschützten Ort. Transport: bei Raumtemperatur bis zu drei Wochen. Längere Lichteinwirkung vermeiden. Trocken lagern. |
| Sicherheitsdatenblatt: | herunterladen |
| Product specifications |
Spektrale Eigenschaften
| Anregungs-/Absorptionsmaximum / nm: | 684 |
|
ε |
198000 |
| Emissionsmaximum / nm: | 710 |
| Fluoreszenz-Quantenausbeute: | 0.2 |
| CF260: | 0.07 |
| CF280: | 0.03 |
Zitierungen
- Kodaka, M.; Kikuchi, A.; Kawahira, K.; Kamada, H.; Katsuta, R.; Ishigami, K.; Suzuki, T.; Yamamoto, Y.; Inoue, J. Identification of a novel target of sulforaphane: Sulforaphane binds to acyl-protein thioesterase 2 (APT2) and attenuates its palmitoylation. Biochemical and biophysical research communications, 2024, 726, 150244. doi: 10.1016/j.bbrc.2024.150244
- Kang, J.‐Y.; Mun, D.; Chun, Y.; Park, D.‐S.; Kim, H.; Yun, N.; Joung, B. Engineered small extracellular vesicle‑mediated NOX4 siRNA delivery for targeted therapy of cardiac hypertrophy. Journal of Extracellular Vesicles, 2023, 12(10), 12371. doi: 10.1002/jev2.12371
- Bashore, C.; Prakash, S.; Johnson, M. C.; Conrad, R. J.; Kekessie, I. A.; Scales, S. J.; Ishisoko, N.; Kleinheinz, T.; Liu, P. S.; Popovych, N.; Wecksler, A. T.; Zhou, L.; Tam, C.; Zilberleyb, I.; Srinivasan, R.; Blake, R. A.; Song, A.; Staben, S. T.; Zhang, Y.; Arnott, D.; Fairbrother, W. J.; Foster, S. A.; Wertz, I. E.; Ciferri, C.; Dueber, E. C. Targeted Degradation via Direct 26S Proteasome Recruitment. Nature Chemical Biology, 2023, 19(1), 55–63. doi: 10.1038/s41589-022-01218-w
- de Paiva, I. M.; Vakili, M. R.; Soleimani, A. H.; Tabatabaei Dakhili, S. A.; Munira, S.; Paladino, M.; Martin, G.; Jirik, F. R.; Hall, D. G.; Weinfeld, M.; Lavasanifar, A. Biodistribution and Activity of EGFR Targeted Polymeric Micelles Delivering a New Inhibitor of DNA Repair to Orthotopic Colorectal Cancer Xenografts with Metastasis. Mol. Pharmaceutics, 2022, 19(6), 1825–1838. doi: 10.1021/acs.molpharmaceut.1c00918
Cy® ist eine registrierte Warenmarke der Cytiva.
Dieses Produkt wird nur für Forschungszwecke angeboten und verkauft. Es wurde nicht auf Sicherheit und Wirksamkeit in Nahrungsmitteln, pharmazeutischen Produkten, medizinischen Vorrichtungen, Kosmetika sowie für gewerbliche oder andere Einsatzzwecke getestet. Der Verkauf gewährt oder impliziert nicht die Erlaubnis zur Verwendung in der In-vitro-Diagnostik, bei der Herstellung von Nahrungsmitteln oder pharmazeutischen Produkten, in medizinischen Vorrichtungen sowie in kosmetischen Erzeugnissen.
Kurzlink - de.lumiprobe.com/sh/p/n
Die eingegebene Zahl ist falsch..

























 $
$ 
