PreciseGreen dsDNA-Quantifizierungskit dient der Bestimmung niedriger dsDNA‑Konzentrationen, die mittels spektrophotometrischer Methode bei 260 nm nicht detektiert werden können. PreciseGreen Reagenz bindet selektiv an die doppelsträngige DNA, sodass Nukleotide, einzelsträngige DNA, RNA, Proteine und andere Verunreinigungen keinen Einfluss auf die Messergebnisse haben.
Der lineare Bereich für die DNA-Konzentrationsbestimmung mit dem Kit reicht von 1 pg/µl bis 5 ng/µl. Der an die doppelsträngige DNA gebundene Farbstoff weist ein Absorptionsmaximum bei 503 nm und ein Emissionsmaximum bei 525 nm auf. Messungen können mit jedem Fluorometertyp durchgeführt werden.
Bestandteile
| Komponente | Anzahl | |||
|---|---|---|---|---|
|
1102-20 20 assays |
1102-200 200 assays |
B1102 200 assays |
||
| AA650, dsDNA-Standard / dsDNA quantitative standard, 100 ng/ul in TE‑Puffer, 100 uL | 1 | — | — | |
| 42010, PreciseGreen® für die dsDNA-Quantifizierung, 200×, 1 mL | — | 1 | — | |
| 12010, PreciseGreen® für die dsDNA-Quantifizierung, 200×, 100 uL | 1 | — | 10 | |
| N2150, TE‑Puffer, 20x, 25 mL | 1 | 1 | 1 | |
| BA650, dsDNA-Standard / dsDNA quantitative standard, 100 ng/ul in TE‑Puffer, 1 mL | — | 1 | 1 | |
Unter 4 °C lagern. Nicht einfrieren! Transport: bei Raumtemperatur bis zu drei Wochen. Längere Lichteinwirkung vermeiden. Trocken lagern.
Haltbarkeit: 12 Monate.
Die oben aufgeführte Reagenzienmenge reicht für ca. 200 Messungen inkl. Proben und Standards bei einem Messvolumen von 2 ml (das Mindestmessvolumen für eine 3,5 ml Makroküvette). Die Anzahl der Messungen kann sich je nach Messvolumen ändern. Die empfohlenen Messvolumina für die gängigen fluorometrischen Geräte sind in der nachstehenden Tabelle angeführt.
Empfohlene Messvolumina für die DNA-Konzentrationsbestimmung mit PreciseGreen Farbstoff:
| Gerätetyp | Messvolumen (VProbe) | Volumen der PreciseGreen Farbstoffarbeitslösung | Volumen verdünnter DNA‑Probe | |
|---|---|---|---|---|
| Küvetten-Fluorometer | 3,5 ml Küvette | 2 ml | 1 ml | 1 ml |
| Andere Küvetten | ca. 75 % des Küvettenvolumens | 37,5 % des Küvettenvolumens | 37,5 % des Küvettenvolumens | |
| Mikroplatten-Fluorometer | 96-Well-Mikroplatte*, pro Well | 0,2 ml | 0,1 ml | 0,1 ml |
| 24-Well-Mikroplatte*, pro Well | 1 ml | 0,5 ml | 0,5 ml | |
| Andere Mikroplatten | ca. 75 % des Wellvolumens | 37,5 % des Wellvolumens | 37,5 % des Wellvolumens | |
| Mikrovolumen-Spektralphotometer* | 0,1 ml | 0,05 ml | 0,05 ml | |
*Es ist empfohlen, ein Pipettiervolumen von weniger als 2 μl zu vermeiden, um die Genauigkeit und Präzision der Messungen zu gewährleisten.
Verfahren
! Um mögliche Pipettierverluste auszugleichen, stellen Sie einen 10–25 % Überschuss der 1× TE Pufferlösung und Farbstoffarbeitslösung her.
1. Ansetzen der 1× TE Pufferlösung
Stellen Sie eine ausreichende Menge der 1× TE Pufferlösung unter Berücksichtigung von Messvolumen und Probenanzahl her (inkl. 5 Verdünnungen des dsDNA-Standards, siehe Punkt 3). Den 1× ТЕ Puffer erhalten Sie, indem Sie 20× TE Konzentrat mit deionisiertem Wasser 20-fach verdünnen (prüfen Sie das empfohlene Messvolumen für das verwendete Gerät anhand der Tabelle).
Verwenden Sie zur Berechnung des Puffervolumens (V1× Puffer) folgende Formel:
V1× Puffer = VProbe × (NProben+ 5),
wo VProbe — Volumen einer Probe oder eines Standards, NProben — Anzahl der Proben und 5 — Anzahl der DNA-Standards (inkl. der Leerprobe).
2. Ansetzen der Farbstoffarbeitslösung
Tauen Sie das Farbstoffröhrchen auf und mischen Sie den Röhrcheninhalt gründlich. Setzen Sie eine ausreichende Menge der Arbeitslösung unter Berücksichtigung der Probenanzahl an. Das Volumen der PreciseGreen Farbstoffarbeitslösung muss 50 % des Messvolumens betragen. Stellen Sie die Farbstoffarbeitslösung her, indem Sie 200× PreciseGreen Farbstoffkonzentrat mit 1× ТЕ Puffer 200-fach verdünnen.
! Angesetzte Farbstoffarbeitslösung ist innerhalb von 3 Stunden aufzubrauchen.
Verwenden Sie zur Berechnung des Volumens der PreciseGreen Farbstoffarbeitslösung (VPreciseGreen) folgende Formel:
VPreciseGreen = 1/2 × VProbe × (NProben+ 5),
wo VProbe — Volumen einer Probe oder eines Standards, NProben — Anzahl der Proben und 5 — Anzahl der DNA-Standards (inkl. der Leerprobe).
! Verwenden Sie zur Herstellung der Farbstoffarbeitslösung ausschließlich Kunststoffgefäße. Ein Glasgefäß kann den Farbstoff adsorbieren, was zur Verringerung der Farbstoffkonzentration in den Proben und Beeinflussung der Messergebnisse führen kann.
3. Ansetzen der Standards
Stellen Sie eine DNA-Stammlösung mit einer Konzentration von 2 ng/μl in 1× ТЕ Puffer her, indem Sie 30 μl dsDNA-Standard aus dem Kit mit 1,47 ml 1× ТЕ Puffer in einem Röhrchen mischen. Stellen Sie aus dieser Stammlösung DNA‑Standardlösungen mit folgenden Konzentrationen her: 2 ng/μl, 200 pg/μl, 20 pg/μl, 2 pg/μl (siehe nachstehende Tabelle).
! Das vorgeschlagene Verdünnungsschema der DNA-Stammlösung berücksichtigt Pipettierverluste bei der Herstellung von Verdünnungen mit einer DNA‑Endkonzentration von 0 bis 2 ng/μl. Die nach diesem Schema angesetzten 1,5 ml DNA-Stammlösung reichen für die Herstellung der DNA-Standardlösungen für Messungen in einer 3,5 ml Küvette (bei einem Messvolumen von 2 ml). Für ein kleineres Messvolumen kann ein geringeres Volumen der DNA-Stammlösung angesetzt werden.
| Volumen der 1× TE Pufferlösung, μl | Volumen der DNA‑Stammlösung 2 ng/μl, μl | Konzentration der DNA‑Standardlösung | Endkonzentration des DNA-Standards im Messvolumen |
|---|---|---|---|
| 0 | 1000 | 2 ng/μl | 1 ng/μl |
| 900 | 100 | 200 pg/μl | 100 pg/μl |
| 990 | 10 | 20 pg/μl | 10 pg/μl |
| 999 | 1 | 2 pg/μl | 1 pg/μl |
| 1000 | 0 | 0 pg/μl | 0 pg/μl |
Mischen Sie jede DNA-Standardlösung mit der Farbstoffarbeitslösung im Verhältnis 1:1 (prüfen Sie das Messvolumen (VProbe) anhand der obigen Tabelle).
! Stellen Sie einen nicht linearen Verlauf der Kalibrierkurve an den Grenzen des dynamischen Bereichs des Gerätes fest, so passen Sie die Konzentrationen der Standardlösungen an, um die Möglichkeiten des Fluorometers optimal zu nutzen.
4. Vorbereitung der Proben
Verdünnen Sie die zu untersuchende DNA-Probe mit 1× TE-Puffer, sodass das Probenvolumen 50 % des Messvolumens beträgt. Fügen Sie das gleiche Volumen der PreciseGreen Farbstoffarbeitslösung hinzu und mischen Sie.
! Das Ausgangsvolumen der Probe kann beliebig sein, die Endkonzentration nach Verdünnung mit 1× TE-Puffer und Hinzufügung der PreciseGreen Farbstoffarbeitslösung muss jedoch im Bereich von 1 pg/μl bis 5 ng/μl liegen.
5. Inkubieren Sie alle hergestellten Standardlösungen und DNA-Proben für 5 Minuten bei Raumtemperatur.
6. Fluoreszenzmessung
Führen Sie Fluoreszenzmessungen der Standardlösungen und DNA-Proben durch (der an die doppelsträngige DNA gebundene Farbstoff weist ein Absorptionsmaximum bei 503 nm und ein Emissionsmaximum bei 525 nm auf).
7. DNA-Konzentrationsberechnung
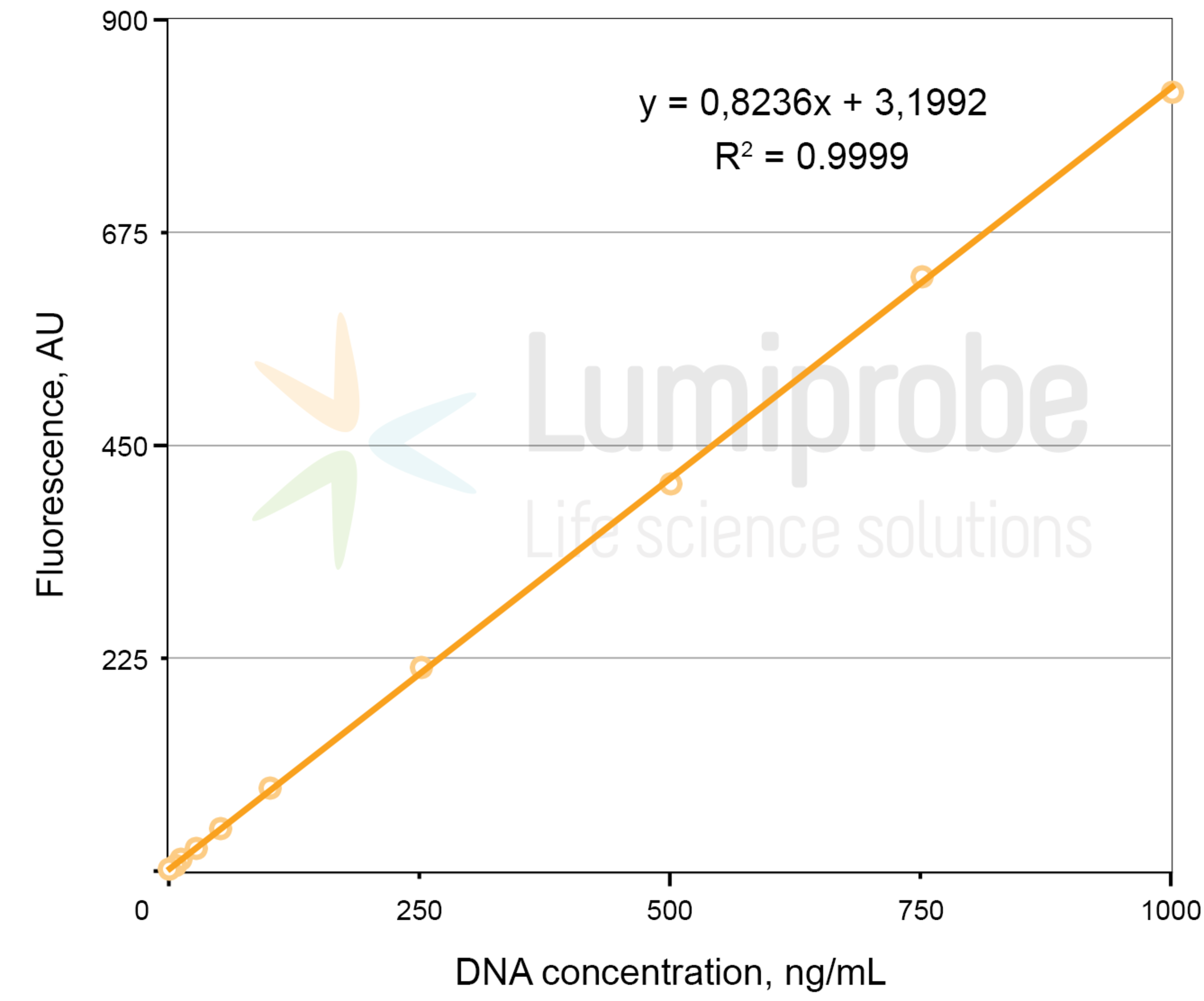
Erstellen Sie eine Kalibrierkurve anhand der Angaben zur Fluoreszenz der Standardlösungen. Approximieren Sie diese Daten durch eine lineare Funktion und ermitteln Sie die Funktionsparameter A und B. Die lineare Abhängigkeit zwischen Fluoreszenz (FL) und Konzentration (C) sieht wie folgt aus:
FL= A × C + B , wo FL — Fluoreszenzintensität in relativen Fluoreszenzeinheiten und C — DNA-Konzentration, A und B — Parameter der linearen Funktion.
DNA-Konzentration in einer verdünnten DNA-Probe:
CProbe = (FLProbe − B)/A , wo FLProbe — Probenfluoreszenz, A und B — Parameter der ermittelten linearen Funktion.
DNA-Konzentration in der Ausgangsprobe:
Сinit = VProbe × CProbe/Vinit , wo VProbe — Messvolumen, Vinit — Volumen der Ausgangsprobe, die zur Herstellung der Endprobe (in Messvolumen) verwendet wurde.
Um notwendige Berechnungen durchzuführen, verwenden Sie unseren Rechner: Rechner für die DNA-Quantifizierung und Lösungs- und Verdünnungsrechner.
Beispiel einer linearen Regression: Fluoreszenz gegen DNA-Konzentration
Related kits
PreciseGreen® dsDNA-Quantifizierungskit
Ein Kit für die Quantifizierung doppelsträngiger DNA mit dem Fluorophor PreciseGreen®.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 1102-20 |
20 assays
|
–
|
21 Tagen. | |
| 1102-200
/ 1 ml Farbstofflösung
|
200 assays
|
$450
|
1 Tagen. | |
| B1102
/ 10 x 100 ul Farbstofflösung
|
200 assays
|
$500
|
1 Tagen. |







 $
$ 

