Diese Kits sind zusammengestellt um Fluorophore (fluoreszierende Farbstoffe) schnell in die Zusammensetzung von Antikörpern einzuführen (2–3 Markierungen pro 1 Molekül Protein). Jedes Kit enthält Komponenten für 10 Reaktionen × 100 µg Antikörper. Das Funktionsprinzip beruht auf der Verwendung von Succinimidesterfarbstoffen (im Überschuss), die in einer schwach alkalischen Umgebung mit freien Aminogruppen des Antikörpers reagieren (N-terminalen Aminogruppen, Aminogruppen an Lysinen). Die nachfolgende Reinigung des Antikörpers von nicht reagiertem Reagenz erfolgt durch Gel-Filtration auf Mikrosäulen (im Kit enthalten).
Bestandteile
| Komponente | Anzahl | |||||||
|---|---|---|---|---|---|---|---|---|
|
1321-10rxn 10 Reaktionen |
3321-10rxn 10 Reaktionen |
7321-10rxn 10 Reaktionen |
5321-10rxn 10 Reaktionen |
6321-10rxn 10 Reaktionen |
1821-10rxn 10 Reaktionen |
6821-10rxn 10 Reaktionen |
||
| N1320, Sulfo-Cyanin3 NHS-Ester, 1 rxn | 10 | — | — | — | — | — | — | |
| N3320, Sulfo-Cyanin5 NHS-Ester, 1 rxn | — | 10 | — | — | — | — | — | |
| N7320, Sulfo-Cyanin5.5 NHS-Ester, 1 rxn | — | — | 10 | — | — | — | — | |
| N5320, Sulfo-Cyanin7 NHS-Ester, 1 rxn | — | — | — | 10 | — | — | — | |
| N6320, Sulfo-Cyanin7.5 NHS-Ester, 1 rxn | — | — | — | — | 10 | — | — | |
| N1820, AF 488 NHS-Ester, 1 rxn | — | — | — | — | — | 10 | — | |
| N2825, AF 594 NHS-Ester, 1 rxn | — | — | — | — | — | — | 10 | |
| 16115, Desalting receptacle vial, 1.5 mL, 10 pcs | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 18115, Desalting spin column with waste vial, 10 pcs | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 11125, PBS tablet, for 100 mL of buffer, 1 pcs | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 15050, DMSO (Dimethylsulfoxid), Markierungsgüte, 1 mL | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 1584-05mL, Natriumazidlösung, 3%, 0.5 mL | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 1689-15mL, Natriumbicarbonat, 126 mg | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
Lagern bei 4 °C bis 20nbsp;°C. Nicht einfrieren! Transport: bei Raumtemperatur bis zu drei Wochen. Längere Lichteinwirkung vermeiden. Trocken lagern.
Haltbarkeit: 12 Monate.
Protokoll
1. Vorbereitung des Antikörpers
Der Antikörperpräparat sollte keine Verunreinigungen wie freie Aminosäuren oder andere Proteine wie BSA enthalten. Ebenso sollten keine Bestandteile von Pufferlösungen mit einem pH-Wert von 2–7,5 oder 9–12 vorhanden sein. Wenn der Antikörper in einer Pufferlösung mit einem pH-Wert von 8–8,5 (basierend auf Natriumbicarbonat oder Tris-HCl) vorliegt und garantiert frei von anderen Verunreinigungen ist, kann er ohne zusätzliche Reinigungsschritte verwendet werden. Wenn Sie nicht sicher sind, dass das Antikörperpräparat keine Verunreinigungen enthält, führen Sie unbedingt einen Reinigungsschritt durch. Für die Reinigung des Antikörpers (falls erforderlich) wird empfohlen, eine der folgenden Methoden zu verwenden: Dialyse, Gel-Filtration oder Ultrafiltration auf Säulen unter Verwendung einer 0,1 M Natriumbicarbonatlösung*.
Optimale Bedingungen für die Antikörpermarkierung: Die Konzentration des Antikörpers beträgt 1 mg/ml in einer Lösung von 0,1 M Natriumbicarbonat ohne Fremdverunreinigungen. Die Anwesenheit des Konservierungsmittels Natriumazid in der Antikörperlösung (bis zu einer Konzentration von 0,04%) beeinflusst die Reaktion nicht.
Wenn die Antikörperkonzentration unter 1 mg/ml liegt, muss sie durch Konzentration (Ultrafiltration) auf 1 mg/ml erhöht und anschließend verdünnt werden. Zur vollständigen Reinigung von möglichen Verunreinigungen wird empfohlen, zwei Konzentrations-/Verdünnungszyklen durchzuführen. Nach jeder Konzentration wird der Antikörper mit 0,1 M Natriumbicarbonat verdünnt.
Wenn die Konzentration der Antikörper unter 1 mg/ml liegt, muss sie durch Konzentration (Ultrafiltration) auf 1 mg/ml erhöht und anschließend verdünnt werden. Zur vollständigen Reinigung von möglichen Verunreinigungen wird empfohlen, zwei Konzentrations-/Verdünnungszyklen durchzuführen. Nach jeder Konzentration wird der Antikörper mit 0,1 M Natriumbicarbonat verdünnt.
Die Antikörperkonzentration sollte idealerweise spektrophotometrisch überwacht werden (für diese Zwecke ist ein kuvettenbasierter Spektrophotometer am besten geeignet).
Es ist zu beachten, dass die Konzentration des Antikörpers in der Reaktionsmischung die Markierungsintensität beeinflusst. Zum Beispiel wird bei einer Reaktion mit 100 µg Antikörper in einem Volumen von weniger als 100 µl ein modifizierter Antikörper mit einer Markierungsintensität von bis zu 4–5 Farbstoffmolekülen pro Antikörper erhalten. Bei einer Reaktion mit 100 µg Antikörper in einem Volumen von mehr als 100 µl wird ein modifizierter Antikörper mit einer Markierungsintensität von 0,3–1 Farbstoffmolekülen pro Antikörper erhalten.
* Um 0,1 M Natriumbicarbonat herzustellen, fügen Sie 15 ml deionisiertes Wasser zu dem in der Probengefäß enthaltenen trockenen Natriumbicarbonat aus dem Kit hinzu.
2. Durchführung der Reaktion
2.1. Fügen Sie dem Probengefäß mit dem lyophilisierten Fluorophor (Fluoreszenzfarbstoff) die Antikörperlösung in 0,1 M Natriumbicarbonat hinzu (empfohlene Mengen: 100 µg** Antikörper in 100 µl). Mischen Sie die Lösung auf einem Vortex, bis der Reagenz vollständig gelöst ist, und inkubieren Sie sie 30 Minuten bei Raumtemperatur.
** Wenn die Reaktion mit einer geringeren Menge Antikörper durchgeführt werden soll, müssen Sie den lyophilisierten Reagenz in 10 µl anhydrous DMSO verdünnen und für die Reaktion 1 µl Lösung für jede 10 µg Antikörper entnehmen. Die Reagenzlösung in DMSO sollte nicht gelagert werden.
3. Reinigung des Antikörpers vom Überschuss des Reagenz
3.1. Lösen Sie zuerst die PBS-Tablette in 100 ml Wasser auf.
3.2. Bereiten Sie die Säule vor. Stellen Sie sicher, dass die Säule Raumtemperatur hat. Resuspendieren Sie den Sorbenten auf einem Vortex. Entfernen Sie die Kappe von der Säule, setzen Sie sie in ein Röhrchen zur Flüssigkeitsaufnahme und zentrifugieren Sie die Konstruktion 2 Minuten bei 1000 g (die angegebene Geschwindigkeit muss strikt eingehalten werden; für einen Standardrotor mit einem Radius von 6 cm entspricht 1000 g 3800 U/min; bei der Zentrifugation muss die Orientierung der Säule im Rotor beachtet werden: Der Vorsprung am oberen Teil der Säule sollte vom Zentrum des Rotors wegzeigen). Entfernen Sie nach der Zentrifugation den Filtrat.
3.3. Geben Sie 400 µl PBS-Puffer auf die Säule, zentrifugieren Sie 2 Minuten bei 1000 g. Nach der Zentrifugation entfernen Sie das Filtrat. Übertragen Sie die Säule in ein 1,5-ml-Röhrchen zur Sammlung des Antikörpers, das im Kit enthalten ist.
3.4. Tragen Sie 100 µl*** der Reaktionsmischung in die Mitte der Säule auf, inkubieren Sie 1 Minute, zentrifugieren Sie 2 Minuten bei 1000 g. Der gereinigte Antikörper**** sammelt sich im Röhrchen.
*** Sie können 50 bis 100 µl auf die Säule auftragen. Wenn die Reaktion in einem kleineren Volumen durchgeführt wurde, wird empfohlen, nach der Reaktion das Volumen des Präparats auf mindestens 50 µl zu erhöhen, indem PBS-Puffer hinzugefügt wird.
**** Nach der Zentrifugation kann dem Antikörperpräparat eine Natriumazidlösung (im Kit enthalten) in einer Menge von 1% des Volumens des Präparats zugefügt werden. Bei Bedarf kann das Antikörperpräparat während der Zentrifugation aliquotiert werden. In diesem Fall sollte die mit der Arbeit durchgeführte Aliquot bei +4 °C aufbewahrt werden, die übrigen Aliquots bei −20 °C. Bei +4 °C dürfen nur die Lösungen aufbewahrt werden, denen Natriumazid zugesetzt wurde.
4. Kontrolle der Anzahl der mit dem Antikörper reagierten Fluorophore
Um die Markierungsrate zu berechnen (die Anzahl der Fluorophormoleküle, die auf ein Molekül Antikörper aufgenommen wurden), muss die optische Dichte der Lösung bei einer Wellenlänge von 280 nm (AAB) und bei der Wellenlänge des maximalen Absorptionswertes des Farbstoffs (ADye) gemessen werden. Ein typisches Absorptionsspektrum ist in der Abbildung dargestellt. Die Wellenlänge des maximalen Absorptionswertes des Farbstoffs kann je nach Farbstoff variieren.
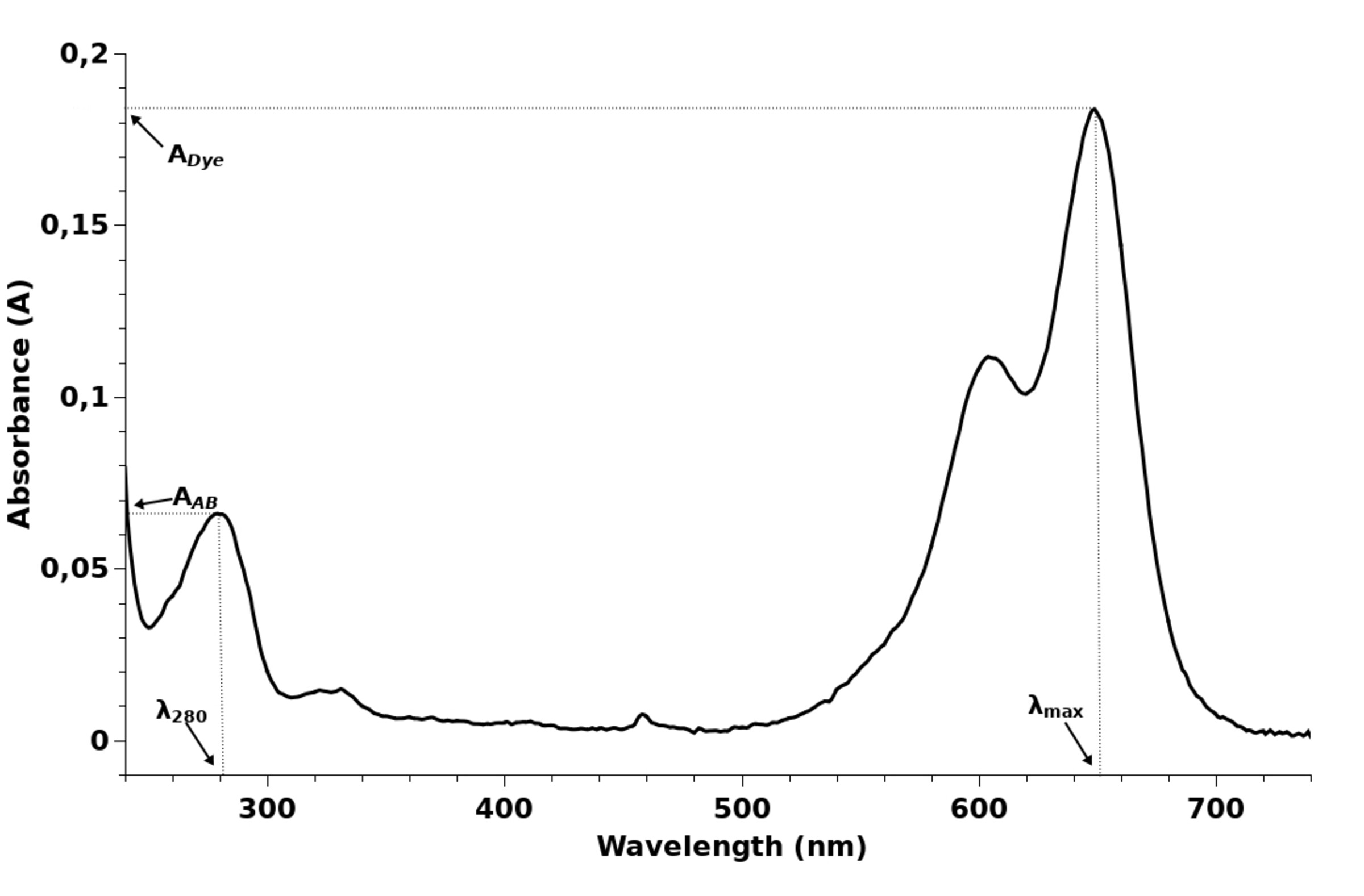
Im Absorptionsspektrum des markierten Antikörpers gibt es einen Farbstoffpeak (langwellig) und einen Absorptionspeak des Antikörpers (~280 nm). Die Anzahl der Fluorophormoleküle pro Molekül Antikörper wird durch die folgende Formel berechnet:
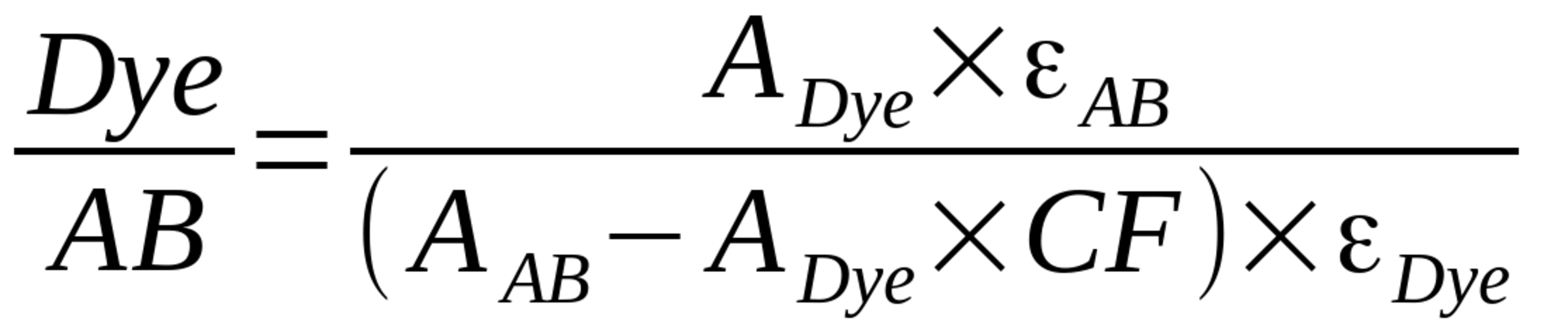
Dabei steht Dye/AB — für die gesuchte Anzahl der Farbstoffmoleküle pro Antikörpermolekül, ADye — für die optische Dichte der Probe bei der Wellenlänge des maximalen Farbstoffabsorptionspeaks, AAB — für die optische Dichte der Probe bei 280 nm, εAB — für den molaren Extinktionskoeffizienten des Antikörpers bei 280 nm (für IgG — 210000), εDye — für den molaren Extinktionskoeffizienten des Farbstoffs bei der Wellenlänge des maximalen Absorptionspeaks (aus der untenstehenden Tabelle entnommen), CF280 — für den Korrekturfaktor des Farbstoffs bei 280 nm (aus der untenstehenden Tabelle entnommen).
| Farbstoff | λmax, nm | ε | CF280 |
|---|---|---|---|
| sulfo-Cyanin3 | 548 | 162 000 | 0.06 |
| sulfo-Cyanin5 | 646 | 271 000 | 0.04 |
| sulfo-Cyanin5.5 | 673 | 195 000 | 0.11 |
| sulfo-Cyanin7 | 750 | 240 600 | 0.04 |
| sulfo-Cyanin7.5 | 778 | 222 000 | 0.09 |
| AF 488 | 495 | 71 800 | 0.10 |
| AF 594 | 586 | 105 000 | 0.51 |
Berechnungsbeispiel
Bei der Färbereaktion des IgG mit dem Farbstoff Sulfo-Cyanine5 wurde nach der Reinigung eine Probe erhalten, deren Absorptionsspektrum oben dargestellt ist. Bestimmen Sie den Grad der Färbung des Antikörpers.
Aus dem Absorptionsspektrum ermitteln wir ADye = 0,184 bei der Wellenlänge des maximalen Absorptionspeaks des Farbstoffs (646 nm, siehe Tabelle), AAB = 0,066 (bei 280 nm). εAB = 210000 für IgG, aus der Tabelle entnehmen wir εDye = 271000 und CF280 = 0,04.
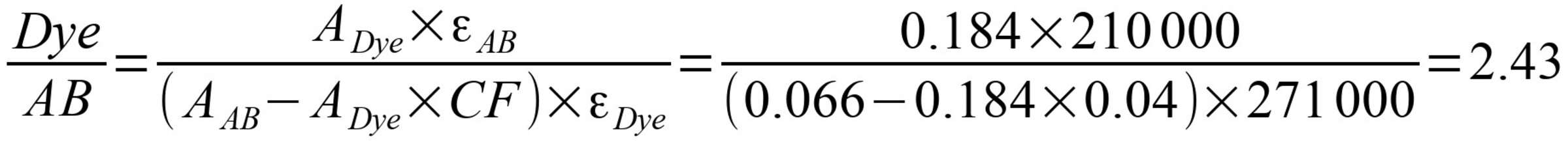
Dye/AB — die gesuchte Anzahl der Farbmoleküle pro Antikörpermolekül, beträgt 2,43 Moleküle Fluorophor pro Antikörper.
Interpretation der Ergebnisse und Lagerung von Antikörpern
Die optimale Markierungsrate für ein starkes fluoreszierendes Signal liegt in den meisten Fällen bei 2–3 Farbstoffmolekülen pro Antikörpermolekül. Eine weitere Erhöhung der Markierungsrate führt aufgrund der Konzentrationslöschung der Fluoreszenz nicht zu einer signifikanten Verstärkung des fluoreszierenden Signals. Wenn die Markierungsrate nicht ausreichend ist, muss die Menge des in die Reaktion eingebrachten Antikörpers reduziert werden. Eine niedrige Markierungsrate kann mit der Verwendung eines abgelaufenen Kits verbunden sein.
Es ist ratsam, Antikörper nach ihrer Bindung an das Substrat nach der Markierung zu testen. Markierte Antikörper können bei −20 °C aufbewahrt werden. Die für die Arbeit verwendete Aliquot sollte bei +4 °C aufbewahrt werden, um mehrfaches Auftauen und Einfrieren zu vermeiden. Die Stabilität der Konjugate wird durch die Stabilität des Antikörpers selbst bestimmt, nicht des Fluorophors. Markierte Antikörper sollten nicht im direkten Sonnenlicht aufbewahrt werden, sind jedoch mit Raumbeleuchtung kompatibel.
Related kits
AF 488 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem AF 488-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 1821-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 1821-10rxn |
10 rxn
|
$450
|
21 Tagen. |

AF 594 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem AF 594-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 6821-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 6821-10rxn |
10 rxn
|
$450
|
21 Tagen. |

Sulfo-Cyanin3 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem Sulfo-Cyanin3-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 1321-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 1321-10rxn |
10 rxn
|
$450
|
21 Tagen. |

Sulfo-Cyanin5.5 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem Sulfo-Cyanin5.5-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 7321-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 7321-10rxn |
10 rxn
|
$450
|
21 Tagen. |

Sulfo-Cyanin5 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem Sulfo-Cyanin5-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 3321-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 3321-10rxn |
10 rxn
|
$397
|
21 Tagen. |

Sulfo-Cyanin7.5 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem Sulfo-Cyanin7.5-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 6321-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 6321-10rxn |
10 rxn
|
$450
|
21 Tagen. |

Sulfo-Cyanin7 Antikörper-Markierungskit
Ein gebrauchsfertiges Kit zur Markierung von Antikörpern und anderen Proteinen mit dem Sulfo-Cyanin7-Farbstoff mittels NHS-Ester-Chemie. Das Kit enthält alle erforderlichen Chemikalien und Verbrauchsmaterialien.| Artikel-Nr. | Packungseinheit | Preis | Vorlaufzeit | Jetzt kaufen |
|---|---|---|---|---|
| 5321-1rxn |
1 rxn
|
$69
|
21 Tagen. | |
| 5321-10rxn |
10 rxn
|
$450
|
21 Tagen. |





 $
$ 

